先天性心疾患の小児において,原疾患による循環動態の変化や血管の走行異常により気管気管支が圧排され,呼吸障害を合併する症例は古くから報告されている1–3).気道病変の合併は心疾患に起因するチアノーゼや心不全と相まって,患者の病態を複雑化かつ重症化させ,その管理を困難にすることが少なくない.先天性心疾患に合併する気道狭窄として先天性気管狭窄症や気管気管支軟化症があり,気管気管支軟化症は血管輪のほか,心室中隔欠損,ファロー四徴,単心室等の合併が多いとされている4).気道病変を伴った先天性心疾患に対する外科治療成績について,単一施設での症例シリーズがいくつか報告されているが4, 5),心疾患の種類による呼吸障害の発症時期,重症度等を詳細に検討した報告は少なく,適切な介入時期や治療方針について定まった指針はないのが現状である.今回,気管気管支軟化症を合併した先天性心疾患15例について,疾患群ごとに臨床像を検討し,適切な治療法および介入時期を明らかにすることを目的とした.
2005年1月から2015年12月の10年間に当科で経験した心血管構造異常が気道狭窄病変の原因もしくは増悪因子と考えられた先天性心疾患は16例(男10例,女6例)であった.その中で心臓手術が気道病変に悪影響を及ぼした可能性がある1例を除き,残りの15例を対象とした.心血管構造異常および気道病変の診断には,実施可能だった全症例で造影CTを行った.2011年3月以前はBrightSpeed Elite(GE Healthcare),2011年4月以降はBrilliance iCT(PHILIPS)を使用した.造影剤2 mL/kgを投与し,自発呼吸または挿管・人工呼吸管理下の症例は手動換気(PEEPなし)で撮影した.周囲の心血管構造物による気管気管支の圧排,扁平化を認めた場合,気管気管支軟化症と診断した.造影CTで診断が困難な場合や,術後ICUで気管内挿管チューブを抜去前に気道評価が必要な場合には気管支鏡を施行し,呼吸性の気道の変形および狭窄を評価した.血管輪群では食道圧排の評価目的に食道造影も行った.心エコーはVivid E9(GE Healthcare)を用いた.肺動脈弁輪径は傍胸骨短軸像の収縮早期で弁輪径が最大になるタイミングで測定し,体表面積ごとの正常値6, 7)に対する割合(% of normal)で比較した.
気道狭窄の原因/増悪因子である心疾患は形態的に3群に分類された.すなわち,I群:肺動脈弁欠損群,II群:左右シャント群,III群:血管輪群であり,これら疾患群別の気道症状の出現時期,初発症状,術前呼吸管理の有無,外科治療の内容および時期,気道症状の予後について,診療録,画像データより後方視的に比較検討した.外科治療の気道病変に対する効果は,術後28日以内に人工呼吸管理を離脱でき,退院後は平素の酸素投与を必要としない場合を「気道症状改善」とし,気管切開や在宅酸素を必要とした場合は「気道症状残存」と判定した.統計学的解析は2群間の比較にはMann–Whitney U-test(両側検定),気道病変の予後に関する評価にはχ2乗検定のFisher’s exact probability testを用いて検定を行い,p<0.05の場合に有意差ありと判定した.
症例一覧をTable 1に示した.症例の内訳は,I群;ファロー四徴+肺動脈弁欠損5例,II群;心室中隔欠損3例,総動脈幹1例,III群;重複大動脈弓4例,右大動脈弓2例であった.ファロー四徴+肺動脈弁欠損は全例染色体異常を合併しており,22q11.2欠失症候群4例,8番モノソミーと由来不明のトリソミー1例であった.心室中隔欠損1例に21トリソミー,2例に先天性十二指腸閉鎖を合併していた.血管輪2例で22q13.3欠失,22q11.2欠失症候群を合併していた.胎児エコーを用いた先天性心疾患の出生前診断の有無をTable 1に記載した.
Table 1 Patient information| Group | Case | CHD | Complication | Prenatal diagnosis of CHD |
|---|
| I | 1 | TOF, absent PV | del.22q11.2 syndrome | − |
| 2 | TOF, absent PV | 8 monosomy+unidentified trisomy | − |
| 3 | TOF, absent PV | del.22q11.2 syndrome | + |
| 4 | TOF, absent PV | del.22q11.2 syndrome | + |
| 5 | TOF, hypoplastic PV | del.22q11.2 syndrome | + |
| II | 6 | large VSD, PDA, PH | 21trisomy, congenital duodenal atresia | − |
| 7 | TrA(I), rAoA, aberrant LSCA, abnormal InnV, PAPVD | — | + |
| 8 | large VSD, ASD, bil. SVC | congenital duodenal atresia | − |
| 9 | large VSD, PH | — | − |
| III | 10 | dAoA | double renal pelvis and ureter | + |
| 11 | dAoA | — | − |
| 12 | dAoA | — | + |
| 13 | dAoA, PA/VSD | — | − |
| 14 | rAoA, lt.dAo, aberrant LSCA, diverticulum of Kommerell | del.22q13.3, epilepsy, developmental retardation | − |
| 15 | rAoA, retroesophageal LBCA, diverticulum of Kommerell | del.22q11.2 syndrome | − |
| I: absent pulmonary valve, II: left-to-right shunt anomaly, III: vascular ring. CHD: congenital heart disease, TOF: tetralogy of Fallot, absent/hypoplastic PV: absent/hypoplastic pulmonary valve, VSD: ventricular septal defect, PDA: patent ductus arteriosus, PH: pulmonary hypertension, TrA: truncus arteriosus, rAoA: right aortic arch, LSCA: left subclavian artery, InnV: innominate vein, PAPVD: partial anomalous pulmonary venous drainage, ASD: atrial septal defect, bil. SVC: bilateral superior venae cavae, dAoA: double aortic arch, PA: pulmonary atresia, lt. dAo: left descending aorta, LBCA: left brachiocephalic artery |
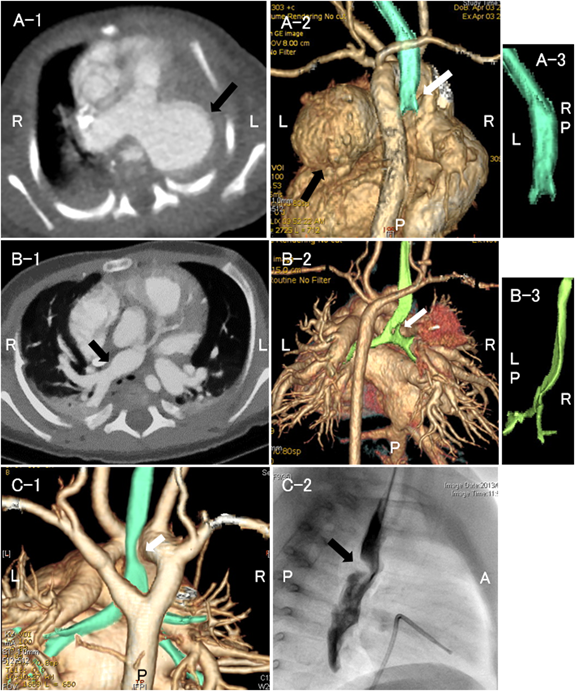
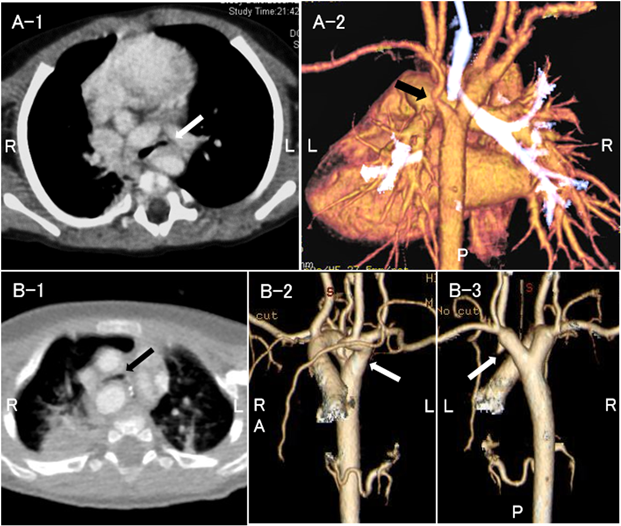
症例4以外の全例に造影CTを行い,心血管構造による気管気管支の圧排,扁平化を認めたため,外的圧迫による二次性気管気管支軟化症と診断した.先天性気管狭窄の症例はなかった.各群の代表的な画像をFig. 1に例示した.I群は主に拡大した肺動脈,II群は拡大した肺動脈や左房,III群は血管輪を形成する大動脈弓や動脈管索等で気管気管支を圧排されていた.症例14は右大動脈弓,Kommerell憩室を伴う左鎖骨下動脈起始異常で血管輪を形成し,左主気管支が主に圧排されていた(Fig. 2A).症例15は右大動脈弓,Kommerell憩室を伴う左腕頭動脈起始異常で非常に稀な血管奇形であった8).造影CTおよび心臓手術の術中所見で左総頸動脈・左鎖骨下動脈と上行大動脈との連続性がなかったことから確定診断した(Fig. 2B).
気道症状と外科手術についてTable 2にまとめた.気道症状の発症月齢は,I群0.6±0.9,II群4.0±2.2,III群3.8±3.2(平均±標準偏差)であった.15例中11例(73%)は経過中に重篤な呼吸不全を呈し,気管内挿管・人工呼吸管理や,呼吸器装着に同意が得られなかった場合はバッグバルブマスク等による緊急処置後にnasal high flowを用いた呼吸管理を行った.I群は気道症状の発症が平均0.6か月と最も早く,重症例である症例3~5は出生後から重度の換気不全を呈した.症例3は家族から外科手術の同意を得られず,腹臥位およびnasal high flowで呼吸管理を行うも状態安定せず,月齢1に亡くなった.症例4は出生直後から挿管・人工呼吸管理を行ったが,肺コンプライアンスが非常に不良であった.腹臥位とした後,酸素飽和度および血圧の著しい低下を認めたため,体位は仰臥位に戻した.両側気胸を合併しており,ドレナージするも呼吸・循環動態ともに改善せず,日齢1に死亡した.造影CT,気管支鏡ともに施行できなかったが,心エコーで左右肺動脈の著明な拡大を認め,それによる気管気管支の圧排が考えられた.症例5は月齢1に肺動脈絞扼術+肺動脈縫縮+modified Blalock–Taussig shuntを行ったが,左右肺動脈の拡張とそれによる気管気管支の圧排が徐々に増悪した.腹臥位およびnasal high flowで呼吸管理を行うも呼吸不全が増悪し,月齢6に挿管・人工呼吸管理となった.心内修復術(ICR)に向けて心臓カテーテル検査予定であったが,感染を併発し,月齢7に呼吸不全で亡くなった.I群,II群は全例術前呼吸管理を必要とした.III群の中で呼吸管理を必要とした2例はいずれも染色体異常合併例であった.気道病変の初発症状は喘鳴,啼泣時チアノーゼ等が多かったが,重症度は症例により様々であり,初発症状は軽微であっても感染等を契機に急性増悪し,挿管管理となった例も少なくなかった.
Table 2 Surgical information and pre/postoperative respiratory symptoms| Group | Case | Age at onset (months) | Age at surgery (months) | Pre-operative ventilation | Operation | Post-operative condition |
|---|
| I | 1 | 2 | 7 | + | ICR | improved |
| 2 | 1 | 5 | + | ICR | improved |
| 3 | 0 | (1)* | NHF | No surgery | dead |
| 4 | 0 | (0)* | + | No surgery | dead |
| 5 | 0 | 1 | + | PAB, PA plication, m-BTS | dead |
| II | 6 | 4 | 1) 4 | + | 1) PAB, PDA ligation | improved |
| 2) 11 | 2) ICR |
| 7 | 7 | 1) 11 | + | 1) ICR (Rastelli, PA plication) | tracheotomy |
| 2) 22 | 2) Aortopexy, division of abnormal InnV |
| 3) 26 | 3) Division of aberrant LSCA, tracheotomy |
| 8 | 3 | 4 | + | ICR | improved |
| 9 | 2 | 5 | + | PAB | dead |
| III | 10 | 10 | 15 | − | Division of vascular ring | improved |
| 11 | 1 | 6 | − | improved |
| 12 | 4 | 9 | − | improved |
| 13 | 3 | 4 | − | improved |
| 14 | 3 | 7 | + | tracheotomy |
| 15 | 2 | 6 | + | improved |
| I: absent pulmonary valve, II: left-to-right shunt anomaly, III: vascular ring. ICR: intracardiac repair, NHF: nasal high flow ventilation, PAB: pulmonary arterial banding, PA plication: pulmonary arterial plication, m-BTS: modified Blalock–Taussig shunt, PDA: patent ductus arteriosus, InnV: innominate vein, LSCA: left subclavian artery, *Age of death (months) |
I群では,2例にICRを施行し,気道症状が改善したが,3例(60%)はICR前に呼吸不全で死亡した.II群では,心室中隔欠損3例中,ICRを行った2例は気道症状が改善したが,症例9は肺動脈絞扼後も感染等を契機に呼吸不全を繰り返し,月齢13に心肺停止に陥り死亡した.症例7は総動脈幹(Collet Edwards分類I型)で右大動脈弓,左鎖骨下動脈起始異常,大動脈弓下走行の左無名静脈走行異常を伴い,Rastelli手術+左肺動脈縫縮後も呼吸不全が進行し,大動脈吊り上げ術+無名静脈切離,さらに左鎖骨下動脈切離+気管切開を行い,状態が安定した.III群は6例全例に血管輪解除を行い,症例14を除いて,気道症状は改善した.症例13は血管輪解除により気道症状改善したため,体重増加を待って二期的にICRを行った.症例14は,血管輪の診断前に,気管支鏡で気管分岐部から両側主気管支にかけて呼気時に増悪する気道の扁平化を認め,気管気管支軟化症の診断で気管切開を行った.その後も気道狭窄症状が改善せず,月齢7の造影CTで血管輪に気づかれ,同月,解除を行った.血管輪解除後,人工呼吸管理は離脱できたものの気管支鏡で気管分岐部の扁平化が残存しており,入眠時や気道感染時には酸素投与を行っている.
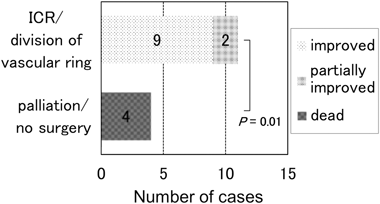
手術月齢は,I群2.8±3.0,II群6.0±3.4,III群7.8±3.9(平均±標準偏差)であり,初発症状出現から初回手術までの平均待機月数は,I群2.2±2.2,II群2.0±1.8,III群4.0±1.6(平均±標準偏差)であった.術前に死亡した症例はその時点までに外科的介入が必要であったと考え,死亡月齢を手術月齢として計算した.症例ごとに経過のばらつきが大きく,Mann–Whitney U-testを用いた群間比較では,明らかな統計学的有意差は得られなかった.ICRまたは血管輪解除による気道圧迫解除を行った11例中9例(82%)で気道症状が改善した.一方,死亡した4例は全例ICRが施行されていなかった(Fig. 3).気道症状残存の2例は心臓手術前あるいは同時に気管切開を行った.外科手術による気道症状の予後について,Fisher’s exact probability testを用いて検定を行った結果,ICR未施行は有意に予後不良であった(p=0.01).
基礎疾患と予後との検討では,I群の5例中3例(60%),出生前診断されていた症例3~5が全例死亡しており予後不良と考えられたが,症例数が少なく,疾患群間および出生前診断の有無による統計学的有意差は得られなかった.I群を予後良好2例(症例1, 2)と予後不良3例(症例3~5)に分け,出生時の肺動脈弁輪径(% of normal)を比較した結果,予後良好例96%±7.1(平均±標準偏差),予後不良例120%±30.3(平均±標準偏差)であったが,症例毎のばらつきが大きく統計学的有意差は得られなかった.また,染色体異常合併8例中4例(50%)が死亡もしくは症状残存しており,特に22q11.2欠失症候群は5例中3例(60%)と死亡率が高かった.
今回の検討から,以下の3つの臨床的な可能性が明らかになった.第1に,全疾患群でICRまたは血管輪解除による気道圧迫解除を施行しなかった症例は予後不良であり,病態の改善には外科治療が必要である.第2に,血管輪と比較して,その他の群はより早期に外科治療が必要になる可能性がある.第3に,染色体異常合併例は,術前の気道症状増悪,心疾患治療後の気道症状残存のリスクが高いという点である.
第1に,全疾患群でICRまたは血管輪解除による気道圧迫解除を施行しなかった症例は予後不良であり,病態の改善には外科治療が必要である.今回の検討では,ICRまたは血管輪解除による気道圧迫解除を行った症例は全例生存しており,82%で気道症状が改善した.姑息術で待機していた症例や手術が行えなかった症例は全例死亡しており,統計学的有意差をもって予後不良であった.圓尾らは気管狭窄もしくは気管気管支軟化症を合併した,先天性心疾患に対する外科治療成績を報告している4).気管気管支軟化症合併例に対し,圧迫病変の解除,血管吊り上げ術等が行われ,院内死亡はなく,遠隔期死亡2例(10%)であった.術後抜管は20例中18例(85%)で成功しており,割合は今回の検討と同程度であった.気管気管支軟化症合併で,外科治療後も抜管できず気管切開を必要とした2例は21トリソミー,多発奇形合併と報告されており,染色体異常合併例では心疾患治療後も気道症状が残存するリスクが高い可能性がある.阿部らの報告では,気道閉塞病変を伴った先天性心疾患21例の検討で,心臓根治術群7例中7例(100%),姑息術群10例中7例(70%),気道手術群4例中2例(50%)が,術後に呼吸管理離脱可能であった5).術後死亡は根治術群0例,姑息術群3例(30%),気道手術群2例(50%)であり,心臓根治術を優先することが生命予後および呼吸管理からの早期離脱に有利である可能性が報告されている.
第2に,血管輪と比較して,その他の群はより早期に外科治療が必要になる可能性がある.I群は気道症状の出現が平均0.6か月と最も早く,重症例は出生直後から重度の換気不全を呈した.新生児期には気道症状が軽微だった症例も感染等を契機に急性増悪し,準緊急的にICRを必要とした.I群で出生前診断されていた症例3~5は全例死亡しており,予後不良であった.本検討では統計学的有意差は示せなかったが,肺動脈弁欠損を伴うファロー四徴で出生前診断される症例は重症例が多く予後不良である可能性は過去の報告でも指摘されている9).その他の予後不良因子として,Balloon型の肺動脈形態,大きい肺動脈弁輪径,胎児水腫,術前人工呼吸管理等が報告されており10–12),今後さらなる検討が必要な疾患である.肺動脈弁欠損でみられる呼吸不全は,瘤状に拡張した肺動脈が気管気管支を圧迫するためと考えられ,Takabayashiらは患児を腹臥位にし,かつ,両側の肩から大腿に枕を置いて前胸部の圧迫を避けることが呼吸・循環の安定化に有効であったと報告している13).当院でも,呼吸不全に対し腹臥位での呼吸管理を行っているが,症例4は腹臥位とした後に酸素飽和度および血圧が低下した.その原因として,気胸に加え,腹臥位による前胸部の圧迫が循環に不利に働いた可能性がある.枕の配置等,体位調整に改善が必要と考えられた.重症例においても,外科治療での生存期間や呼吸症状の改善が期待されるが,呼吸・循環が安定せずに手術困難な場合や,家族が手術を希望されない場合もあり,管理に難渋することが少なくない.II群では,姑息術後の外来フォロー中に1例が呼吸不全急性増悪で亡くなったが,より早期にICRを行うことで救命できた可能性はある.III群は手術待機月数が平均4.0ヶ月と最も長く,かつ6例中4例(67%)が呼吸管理なく待機できたことから,気道閉塞の急性増悪リスクは比較的低いと考えられた.血管輪に対する外科治療のタイミングについて,Humphreyらの検討14)では,生後6か月から3歳までの手術症例は術後の慢性症状残存が最も少なかったと報告されている.3歳以降の手術症例では外的圧迫による二次性気管気管支軟化症の可逆性低下が考えられ,3歳までの血管輪解除が有効である可能性が示唆されている.肺動脈弁欠損や左右シャント疾患の患児は,血管輪のような純粋な気道の外的圧迫だけでなく,心疾患に起因するチアノーゼ,うっ血性心不全等が併存するために呼吸障害が重症化しやすいと考えられ,感染等を契機とした急性増悪のリスクが高い.したがって,特に血管輪以外の疾患群では気道症状が現れた場合,できる限り早期にICRを目指すべきと考えられる.
第3に,染色体異常合併例は,術前の気道症状増悪,および心疾患治療後の気道症状残存のリスクが高い可能性がある.今回の検討では染色体異常合併例の50%が死亡,もしくは術後も気道症状が残存していた.III群の6例中5例で血管輪解除が気道症状改善に有効であったが,症例14のみ気道狭窄病変が残存した原因として,染色体異常に伴う原発性気管気管支軟化症の合併が考えられた.血管輪38例に関するHumphreyらの検討14)でも,DiGeorge, 21トリソミー,CHARGE等を伴った症例は血管輪解除後の症状改善が乏しかったと報告されている.原発性気管気管支軟化症に関連する染色体異常として,21トリソミー,22q11.2欠失症候群,CHARGE症候群等の報告があり15),呼吸障害重症化との関連が考えられる.これらの疾患では先天的な肺胞壁の形成不全16)や肺内肺動脈の分枝異常による肺内気管支の圧排17)も指摘されており,心疾患術後も呼吸管理に難渋する可能性が高い.染色体異常合併例の管理においては抜管前の気管支鏡による気道評価等,より慎重な対応が求められる.
気道病変の合併は,(1)心疾患治療前の呼吸障害急性増悪による生命リスクの増加,(2)人工呼吸管理中の鎮静による脳神経系への影響や,嚥下機能,発語等の精神運動発達への影響,(3)母子分離による人格形成や対人関係構築への影響等も懸念され,患児の良好な成長発達にとって不利益が大きい.また,心疾患術後に気道病変が残存した場合,患者・家族のQuality of Life(QOL)に大きく影響するため,可能な限り後遺症を残さない管理に努めなくてはならない.そのための治療方針を考える上で,今回の検討は有意義な示唆を与えてくれるものと考える.
本検討のstudy limitationとして,1施設での症例シリーズであり症例数が少ないことが挙げられる.今回は気道病変の予後に関連する因子について統計学的有意差を得られなかったが,今後,症例を蓄積し,さらなる検討を行いたい.
本検討より,ICRまたは血管輪解除による気道圧迫解除が病態改善に必要であることが示された.血管輪以外の疾患群ではより早期に外科治療が必要になる可能性があり,また,染色体異常合併も呼吸障害重症化のリスク因子である可能性がある.適切な時期を見逃さず,早期にICRを含めた外科治療を計画することが気管気管支軟化症を合併した先天性心疾患患児の予後改善につながると考えられる.
利益相反
本研究に関連し,開示すべき利益相反(COI)関係にある企業などはありません.
引用文献References
1) Corno A, Giamberti A, Giannico S, et al: Airway obstructions associated with congenital heart disease in infancy. J Thorac Cardiovasc Surg 1990; 99: 1091–1098
2) Oh KS, Park SC, Galvis AG, et al: Pulmonary hyperinflation in ventricular septal defect. J Thorac Cardiovasc Surg 1978; 76: 706–709
3) Backer CL, Ilbawi MN, Idriss FS, et al: Vascular anomalies causing tracheoesophageal compression. J Thorac Cardiovasc Surg 1989; 97: 725–731
4) 圓尾文子,大嶋義博,吉田昌弘,ほか:気道閉塞病変を合併する先天性心疾患の外科治療.日小児循環器会誌2010; 26: 375–383
5) 阿部正一,厚美直孝,榊原 謙,ほか:先天性心疾患に合併した気道閉塞病変に対する外科治療.日心臓血管外会誌1996; 25: 13–19
6) Kouchoukos NT, Blackstone EH, Hanley FL, et al: Anatomy, Dimensions, and Terminology, in Kirklin/Barratt-Boyes Cardiac Surgery. 4th edition, Philadelphia, Elsevier, 2013, pp33–47
7) Rowlatt UF, Rimoldi HJ, Lev M: The quantitative anatomy of the normal child’s heart. Pediatr Clin North Am 1963; 10: 499–588
8) Ezon DS, Penny DJ: Aortic arch and vascular anomalies, in Allen HD (ed): Moss and Adams’ Heart Disease in Infants, Children, and Adolescents. 9th edition, Philadelphia, Wolters Kluwer, 2016, pp846–848
9) Ravavi RS, Sharland GK, Simpson JM: Prenatal diagnosis by echocardiogram and outcome of absent pulmonary valve syndrome. Am J Cardiol 2003; 91: 429–432
10) Moon-Grady AJ, Tacy TA, Brook MM, et al: Value of clinical and echocardiographic features in predicting outcome in the fetus, infant, and child with tetralogy of Fallot with absent pulmonary valve complex. Am J Cardiol 2002; 89: 1280–1285
11) Brown JW, Ruzmetov M, Vijay P, et al: Surgical treatment of absent pulmonary valve syndrome associated with bronchial obstruction. Ann Thorac Surg 2006; 82: 2221–2226
12) 河津由紀子,稲村 昇,石井 良,ほか:ファロー四徴兼肺動脈弁欠損の生命予後を左右する因子の検討.日小児循環器会誌2011; 27: 88–95
13) Takabayashi S, Shimpo H, Miyake Y, et al: Postoperative prone position management of tetralogy of Fallot with absent pulmonary valve syndrome. Jpn J Thorac Cardiovasc Surg 2005; 53: 150–153
14) Humphrey C, Duncan K, Fletcher S: Decade of experience with vascular rings at a single institution. Pediatrics 2006; 117: e903–e908
15) Carden KA, Boiselle PM, Waltz DA, et al: Tracheomalacia and tracheobronchomalacia in children and adults: An in-depth review. Chest 2005; 127: 984–1005
16) 八巻重雄,堀内藤吾,関野美仁,ほか:ダウン症を伴う先天性心疾患の術後呼吸不全に関する肺病理組織所見からの考察.日胸外会誌1984; 32: 1308–1315
17) Rabinovitch M, Grady S, David I, et al: Compression of intrapulmonary bronchi by abnormally branching pulmonary arteries associated with absent pulmonary valves. Am J Cardiol 1982; 50: 804–813